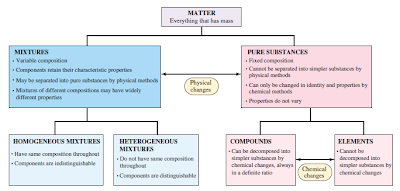
Unsur adalah zat murni yang dapat
diuraikan lagi menjadi zat lain yang lebih sederhana dengan reaksi kimia biasa.
Penulisan lambang unsur mengikuti aturan sebagai berikut:
1.
Lambang unsur diambil dari singkatan nama unsur. Beberapa lambang unsur
berasal dari bahasa Latin atau Yunani nama unsur tersebut.
Misalnya Fe dari
kata ferrum (bahasa latin) sebagai lambang unsur besi.
2.
Lambang unsur ditulis dengan satu huruf kapital.
3.
Untuk Unsur yang dilambangkan dengan lebih dengan satu huruf, huruf pertama
lambang ditulis dengan huruf kapital dan huruf kedua/ketiga ditulis dengan
huruf kecil.
4.
Unsur-unsur yang memiliki nama dengan huruf pertama sama maka huruf
pertama lambang unsur diambil dari huruf pertama nama unsur dan huruf kedua
diambil dari huruf lain yang terdapat pada nama unsur tersebut.
Misalnya, Ra untuk radium dan Rn untuk radon.
Pada
suhu kamar (25 C) unsur dapat berwujud Padat, Cair,dan Gas,
Unsur
Logam: umumnya unsur
logam diberi nama akhiran ium. Umumnya logam ini memiliki titik didih tinggi,
mengilap, dapat dibengkokan , dan dapt menghantarkan panas atau arus
listrik.
· ·
Unsur Non Logam:
umumnya memiliki titik didih rendah, tidak mengkilap,kadang-kadang rapuh tak
dapat dibengkokkan dan sukar menghantarkan panas atau arus listrik.
Senyawa adalah zat yang terbentuk
dari penggabungan unsur-unsur dengan pembagian tertentu. Senyawa dihasilkan
dari reaksi kimia antara dua unsur atau lebih melalui reaksi pembentukan.
Misalnya, karat besi (hematit) berupa Fe2O3 dihasilkan oleh reaksi besi (Fe)
dengan oksigen (O). Senyawa dapat diuraikan menjadi unsur-unsur pembentuknya
melalui reaksi penguraian.
Berikut ini adalah proses
elektrolisis air yang merupakan reaksi kimia yang menguraikan senyawa air
menjadi unsur-unsurnya yaitu hidrogen dan oksigen.
H2O (l)→ H2(g) + O2(g)
Senyawa sebenarnya sudah
banyak terdapat di alam namun kita juga dapat membuat senyawa yang sudah ada dengan
mereaksikan unsur – unsurnya. Salah satu contohnya adalah dengan mereaksikan
natrium padat dengan gas klor yang menghasilkan garam NaCl.
Na(s) + Cl2(g)
→ NaCl(s)
Reaksi ini menghasilkan
nyala terang sebab reaksinya melepaskan sejumlah energi.
(Sumber : General
Chemistry - Whitten-Davis-Peck)





0 komentar: